《藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)》2010版附錄《計(jì)算機(jī)化系統(tǒng)》作為藥品生產(chǎn)質(zhì)量管理體系的重要組成部分,對(duì)計(jì)算機(jī)系統(tǒng)在藥品生產(chǎn)、質(zhì)量控制等環(huán)節(jié)的應(yīng)用提出了明確要求。本文從整體框架和核心條款兩方面進(jìn)行解讀,幫助相關(guān)從業(yè)人員深入理解并有效實(shí)施。
一、整體框架概述
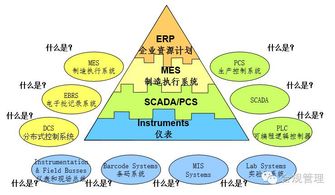
2010版GMP附錄《計(jì)算機(jī)化系統(tǒng)》共分為六章,包括總則、人員與職責(zé)、系統(tǒng)驗(yàn)證、數(shù)據(jù)完整性、系統(tǒng)安全與備份、審計(jì)追蹤等內(nèi)容。其核心目標(biāo)是確保計(jì)算機(jī)化系統(tǒng)在藥品生命周期中的可靠性、數(shù)據(jù)完整性與合規(guī)性,降低藥品質(zhì)量風(fēng)險(xiǎn)。
二、核心條款精華解讀
1. 系統(tǒng)驗(yàn)證要求
條款明確計(jì)算機(jī)化系統(tǒng)必須經(jīng)過(guò)完整的驗(yàn)證流程,包括設(shè)計(jì)確認(rèn)(DQ)、安裝確認(rèn)(IQ)、運(yùn)行確認(rèn)(OQ)和性能確認(rèn)(PQ)。驗(yàn)證文件應(yīng)詳細(xì)記錄驗(yàn)證過(guò)程與結(jié)果,確保系統(tǒng)符合預(yù)定用途。
2. 數(shù)據(jù)完整性原則
系統(tǒng)應(yīng)確保數(shù)據(jù)準(zhǔn)確、完整、可靠且不可篡改。采用電子簽名、審計(jì)追蹤等技術(shù)手段,防止數(shù)據(jù)丟失或修改。數(shù)據(jù)存儲(chǔ)需滿足可追溯性要求,保留時(shí)間符合法規(guī)規(guī)定。
3. 系統(tǒng)安全與訪問(wèn)控制
必須建立嚴(yán)格的權(quán)限管理機(jī)制,區(qū)分不同用戶角色(如管理員、操作員、審計(jì)員),確保敏感操作僅限授權(quán)人員執(zhí)行。系統(tǒng)應(yīng)具備防病毒、防入侵等安全措施,并定期進(jìn)行安全評(píng)估。
4. 系統(tǒng)服務(wù)與供應(yīng)商管理
條款強(qiáng)調(diào)計(jì)算機(jī)系統(tǒng)服務(wù)供應(yīng)商需具備相應(yīng)資質(zhì),并提供持續(xù)的技術(shù)支持。企業(yè)應(yīng)對(duì)供應(yīng)商進(jìn)行審計(jì),確保其服務(wù)符合GMP要求。系統(tǒng)變更、升級(jí)或維護(hù)均需記錄并評(píng)估對(duì)產(chǎn)品質(zhì)量的潛在影響。
5. 備份與災(zāi)難恢復(fù)
系統(tǒng)需定期備份關(guān)鍵數(shù)據(jù),并制定災(zāi)難恢復(fù)計(jì)劃,確保在系統(tǒng)故障時(shí)能快速恢復(fù)運(yùn)行。備份數(shù)據(jù)應(yīng)存儲(chǔ)于安全位置,并進(jìn)行定期恢復(fù)測(cè)試。
三、實(shí)施建議
企業(yè)應(yīng)結(jié)合自身實(shí)際情況,制定詳細(xì)的計(jì)算機(jī)化系統(tǒng)管理規(guī)程,加強(qiáng)人員培訓(xùn),確保系統(tǒng)從選型、驗(yàn)證到日常運(yùn)維均符合GMP要求。定期開(kāi)展內(nèi)部審計(jì),持續(xù)優(yōu)化系統(tǒng)性能與合規(guī)性。
2010版GMP附錄《計(jì)算機(jī)化系統(tǒng)》的實(shí)施不僅是法規(guī)要求,更是保障藥品質(zhì)量與患者安全的重要舉措。通過(guò)深入理解條款內(nèi)涵并有效落實(shí),企業(yè)能夠提升質(zhì)量管理水平,為藥品安全保駕護(hù)航。